“규제에 막힌 유전자치료”…국내 원천기술에도 환자 치료 갈림길
유전자·세포 치료 기술이 희귀소아질환 치료 패러다임을 바꾸고 있다. 국내 연구진이 세계 최초로 선천성 망막질환 치료를 위한 원천기술을 확보했으나, 엄격한 법적 규제와 예산 부족으로 정작 임상시험에 들어가지 못하는 상황이다. 업계와 환자단체에서는 “규제로 인해 실질적 치료 기회가 차단됐다”며, 미래 의료 경쟁력 확보의 분기점이 될 정책 결정을 촉구하고 있다.
국내 사례를 보면, 생후 수개월 만에 선천성 망막질환 진단을 받은 환아들이 유전자·세포 치료만이 유일한 치료수단임에도 불구하고, 법 제약 때문에 임상에조차 참여할 수 없다. 국내 병원에서는 4년 전에 이미 유전자 가위 기반 ‘4세대 프라임’ 기술을 동물실험에 성공해 돌연변이 유전자를 정밀하게 교정할 수 있는 플랫폼을 마련했다. 이 기술은 DNA 이중가닥 중 한 가닥만 선택적으로 절단해, 손상 부위를 변환된 DNA로 신속 교체하기 때문에 기존 방식에 비해 오작동 가능성이 낮다는 점에서 주목받는다. 그러나 현행 첨단재생바이오법은 ‘생체 외 방식’(ex-vivo)만 허용하고, 인체에 직접 유전자를 주입하는 ‘생체 내 방식’(in-vivo)은 임상 시도 자체를 법적으로 차단하고 있다.
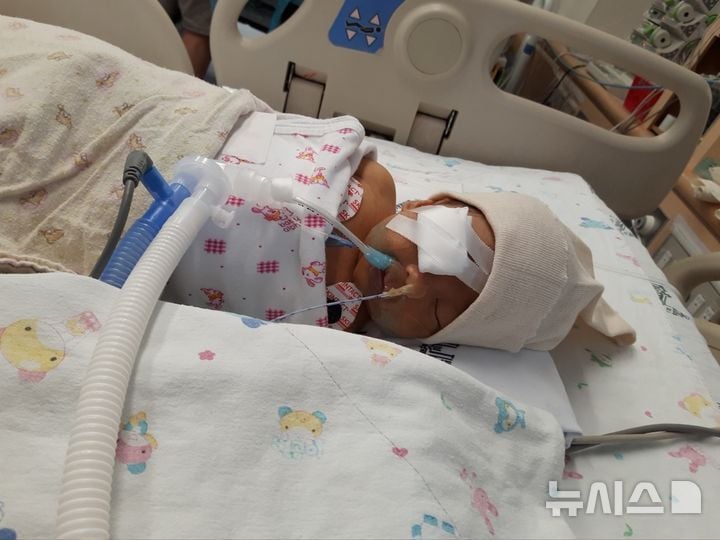
특히 미국·유럽의 경우 의료법상 두 방식 모두를 임상·치료 대상으로 포괄·인정하고 있어 환자 선택권과 신속한 신약 개발의 토대가 마련돼 있다. 미국에서는 이미 첨단 유전자치료가 시판 허가를 받고 임상 연구와 치료 현장에 적용되고 있다. 반면, 한국은 원천기술이 있음에도 구조적으로 임상을 할 수 없어, 약 1800여 명의 희귀소아안질환 환자들이 대기만 하거나 해외 치료를 모색해야 하는 실정이다.
규제뿐만 아니라 예산 문제도 심각하다. 유전자·세포 치료제 개발을 위한 전임상 비용은 50억원 이상이 요구되지만, 정부가 책정한 재생의료 개발 예산은 연 7억원에 불과해 현장 투입조차 어렵다는 지적이 나온다. 이로 인해 기술을 확보하고도 실제 환자 치료까지 이어지지 못하는 이중 장벽이 산업계 발목을 잡고 있다.
정책 변화 조짐도 나타나고 있다. 최근 국회에서는 ‘유전자·세포 치료 활성화 법안’이 발의돼, '인체세포 등' 정의에 유전물질과 핵산물질을 포함해 생체 내 유전자 치료 근거를 마련하려는 논의가 시작됐다. 정부 역시 희귀·난치 질환에 쓰이는 세포치료 규제 완화를 주요 첨단산업 전략으로 제시하며, 현장 중심의 규제 전환을 강조하고 있다. 다만 제도 개선 논의는 국회에 계류 중이고, 실제 예산 지원 확대 등 실행 방안 논의는 후속 과제로 남아 있다.
전문가들은 “기술력에서 앞서고도 환자가 국가 내에서 치료받지 못하는 상황은 바람직하지 않다”며 “법·제도 정비와 충분한 투자 확대가 동반될 때야말로 산업 경쟁력과 국민 건강권을 함께 지킬 수 있다”고 입을 모았다. 산업계는 이번 규제 환경 변화가 실제 신약 임상 및 치료 시장 확대로 이어질지 예의주시하고 있다.

