프라임편집으로 항암제 내성 지도…연세대, 백혈병 정밀치료 앞당긴다
프라임 편집이라는 차세대 유전자 교정 기술이 혈액암 치료 전략을 바꾸는 도구로 부상하고 있다. 연세대 의대 연구진이 만성골수성백혈병에서 항암제 내성을 일으키는 ABL1 유전자 변이를 거의 전수 분석해 약물 반응 지도를 구축하면서, 환자 유전자 정보를 기반으로 한 정밀 항암제 선택 가능성이 한층 커졌다는 평가가 나온다. 업계와 의료계에서는 이번 결과를 만성골수성백혈병 표적치료제 경쟁의 새로운 분기점으로 보고 있다.
연세대 의대 약리학교실 김형범 교수와 정유상, 유구상 박사 연구팀은 프라임 편집 기술을 활용해 만성골수성백혈병 세포에서 ABL1 유전자 단일 아미노산 변이 98퍼센트에 해당하는 1954종을 인위적으로 구축하고, 세대별 표적항암제에 대한 내성 패턴을 체계적으로 분석했다고 25일 밝혔다. 연구 결과는 국제학술지 네이처 바이오메디컬 엔지니어링에 실렸다.
만성골수성백혈병은 BCR와 ABL1이 결합해 생기는 BCR ABL1 융합 유전자가 원인이 되는 대표적 혈액암이다. 이 융합 유전자는 세포 내 ABL1 효소를 비정상적으로 활성화해 백혈병 세포가 분열을 멈추지 못하도록 만든다. 이를 겨냥해 1세대부터 4세대까지 여러 계열의 표적항암제가 개발되면서 상당수 환자에서 장기 생존이 가능해졌다.
하지만 치료가 장기간 이어지면 암세포 안 ABL1 유전자에 새로운 변이가 누적되면서 기존 약물에 듣지 않는 내성이 생긴다. 특정 위치에 어떤 아미노산 변이가 생겼는지에 따라 같은 계열 약물이라도 반응성은 크게 달라진다. 실제 진료에서는 변이가 확인돼도 어떤 약에 내성이 생길지, 어느 약으로 바꿔야 할지 예측하기 어려워 환자 맞춤 치료 전략 수립에 걸림돌이 돼 왔다.
연구팀은 이러한 한계를 해결하기 위해 프라임 편집기를 도입했다. 프라임 편집은 가위처럼 DNA를 자른 뒤 다시 붙이는 기존 유전자 가위와 달리, DNA를 크게 절단하지 않고 원하는 염기를 정밀하게 바꾸는 방식이다. 오탈자 교정을 하듯 한 글자씩 치환이 가능해 특정 유전자의 아미노산 변이를 체계적으로 제작할 수 있다는 점이 특징이다.
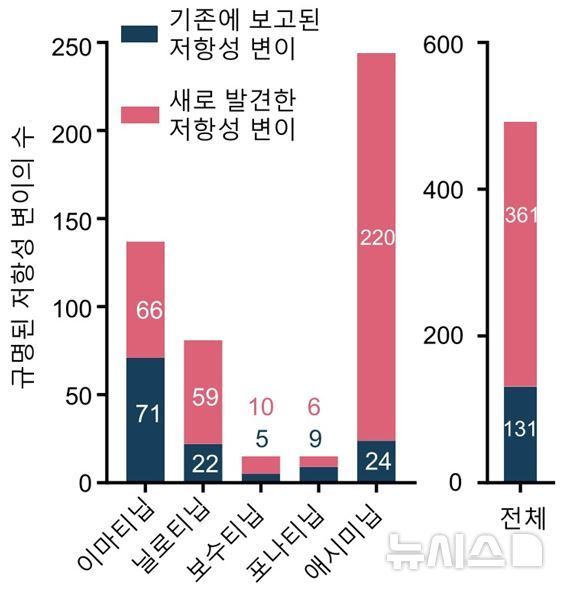
연구팀은 인체 유래 만성골수성백혈병 세포주인 K562 세포 안에서 ABL1 유전자에 발생할 수 있는 단일 아미노산 변이 1998종 가운데 1954종을 프라임 편집으로 실제 구현했다. 이어 이렇게 만든 변이 라이브러리를 대상으로 이마티닙, 닐로티닙, 보수티닙, 포나티닙, 애시미닙 등 1세대부터 4세대까지 대표적인 5종 항암제에 각각 노출시키며 약물 내성 정도를 정량 평가했다.
그 결과 기존 보고가 거의 없던 내성 변이가 대거 드러났다. 연구팀은 지금까지 알려지지 않았던 약물 내성 조합 361쌍을 새로 규명했으며, 최신 임상 진료 지침에 반영되지 않은 새로운 내성 변이들도 다수 발굴했다. 특정 약물에만 강한 내성을 보이는 변이, 여러 약물에 동시에 저항성을 나타내는 변이 등 세분화된 패턴도 확인해 약제 선택 시 피해야 할 변이와 우선 고려해야 할 약물을 가르는 기준을 제시했다.
연구 신뢰도를 높이기 위해 다른 인체 유래 만성골수성백혈병 세포주인 KCL22 세포와 생쥐 모델에서도 동일한 실험을 반복했다. 서로 다른 세포 환경과 동물 모델에서 재검증한 결과, 핵심적인 내성 패턴이 일관되게 재현돼 데이터의 재현성과 활용 가능성이 강화됐다는 설명이다.
이번 연구로 구축된 ABL1 변이와 항암제 내성 데이터베이스는 향후 병원 현장에서 유전자 검사 결과를 해석하는 지침으로 활용될 여지가 크다. 환자에게서 특정 ABL1 변이가 발견됐을 때, 연구팀이 생성한 변이 내성 지도와 대조해 어느 약물에 효과가 떨어질지 미리 예측하고, 반대로 상대적으로 효과가 기대되는 약제를 선제적으로 선택하는 방식이다.
글로벌 제약 업계에서는 이미 백혈병을 포함한 표적 항암제 시장에서 유전자 변이 기반 정밀의료 경쟁이 치열해지는 상황이다. 미국과 유럽에서는 NGS와 같은 차세대 염기서열 분석 기술을 활용해 환자별 암 유전체를 정밀 분석하고, 축적된 변이 데이터베이스를 기반으로 치료제를 매칭하는 시도가 확산되는 추세다. 이번 연세대 연구는 이러한 흐름에 맞춰 국내에서도 특정 유전자에 대한 고해상도 변이 지도와 약물 반응 정보를 직접 만든 사례로 평가된다.
다만 실제 임상 현장에서 광범위한 유전자 변이 분석과 약제 매칭을 적용하려면 규제와 제도 측면의 뒷받침이 필요하다는 지적도 있다. 유전체 검사에 대한 건강보험 적용 범위, 진료지침에 반영할 때의 근거 수준, 약제 변경 과정에서의 규제 절차 등이 정교하게 설계돼야 한다는 것이다. 또한 대규모 유전정보와 치료 반응 데이터가 축적되는 만큼 개인정보 보호와 연구 데이터의 2차 활용 기준을 명확히 하는 작업도 병행돼야 한다.
김형범 교수는 ABL1 유전자 변이 전반에 대한 항암제 내성 정보를 실험적으로 확인한 점을 강조하며, 만성골수성백혈병 환자에서 새로운 변이가 발견되더라도 이번 연구 데이터를 활용해 보다 정밀한 맞춤 치료 전략을 세울 수 있을 것이라고 내다봤다. 산업계와 의료계는 이 같은 유전자 변이 기반 내성 지도가 실제 진료 지침과 항암제 개발 전략에 얼마나 빠르게 반영될지 주시하고 있다.

