“혁신제품 사전상담 확대”…식약처, 의료제품 신속 제품화 뒷받침
의료제품 개발을 둘러싼 국내 규제 환경이 실질적 지원 중심으로 옮겨가고 있다. 식품의약품안전처 산하 식품의약품안전평가원은 ‘의료제품 개발 상담사례집’을 최근 개정 배포하며, 신약과 혁신 의료기기 등 첨단 바이오 분야 신제품 상품화 과정에서 업계의 시행착오 최소화와 신속화에 나섰다. 올해 개정판에는 의약품 141건, 바이오의약품 156건, 의료기기 기술문서 28건, 임상시험 24건 등 최근 1년간 실제 상담 사례가 반영돼, 현업에서 마주치는 규제와 기술적 쟁점이 구체적으로 안내된다. 업계는 이번 개정을 K-바이오 규제 경쟁력의 시험대로 평가 중이다.
상담사례집은 표적단백질분해제, 방사성의약품, mRNA 백신, 항체-약물 복합체(ADC) 등 차세대 바이오 신기술 제품 개발 시 품질 평가와 비임상·임상 안전성 자료 준비 과정, 그리고 허가를 위한 핵심 유의점을 구조적으로 제시한다. 의료기기 부문에서도 전동식의료용흡인기 등 새로운 제품 성능평가 항목, 언어음성장애진단보조소프트웨어 등 인공지능(AI) 기반 진단기기의 임상시험 자료 활용 가능성 등 구체적 컨설팅이 포함됐다.
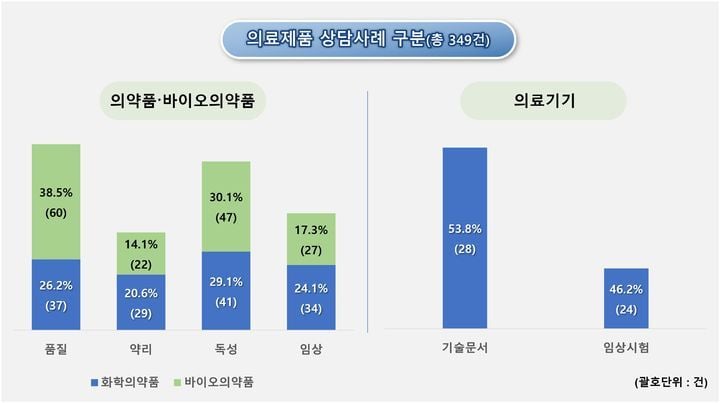
특히 이번 사례집은 복수 분야 융복합 제품에 대한 맞춤형 상담 절차와 신청 방식까지 상세히 담았다. 그간 혁신 바이오의약품과 AI 기반 의료기기 개발자들은 규제와 허가 요건 해석의 불확실성, 임상 경험 부족 등의 현실적 한계에 부딪혀 왔다. 이번 개정 사례집은 각 단계별 주요 쟁점별(품질·비임상·임상)로 체크리스트화돼, 제약·의료기기 스타트업은 물론 대형 기업, 학계에서도 실효성 있는 참고 자료로 평가된다.
미국 FDA와 유럽 EMA 역시 최근 규제기관-기업 간 사전상담 고도화에 집중하고 있다. 국내 식약처의 이번 사례집 개정은 선진국과의 규제 동향 경쟁에서 비교우위를 확보하기 위한 실질 방안으로 해석된다. 다만, 현장에서는 신속한 상담뿐 아니라 임상데이터 해석, 글로벌 승인 사례와의 조화 등 추가적 가이드 강화 요구도 꾸준히 제기된다.
이번 사례집에는 혁신제품 사전상담의 상담대상, 신청방법, 절차 안내 등 실무 내용 역시 새로 담겼다. 신약·의료기기 허가 이전 단계에서 ‘규제 리스크’를 미리 예측하고, 기술·임상의 쟁점에 대한 선제적 대응 전략 마련에 활용될 수 있다는 평가다.
정부는 앞으로도 신속한 허가·제품화 지원을 위해 산업별 맞춤 컨설팅을 지속한다는 계획이다. 전문가들은 “의료제품 혁신을 뒷받침하는 정책·규제 지원이 신기술 산업 성장의 핵심 변수가 되고 있다”며 “상담사례집이 현장 실제에 맞춰 지속적으로 업데이트될 필요가 있다”고 제언했다. 산업계는 이번 개정이 바이오·의료기기 신제품의 국내외 시장 안착에 얼마나 실질적 역할을 할지 예의주시하고 있다.

