“아미반타맙·레이저티닙 병용”…국내 산발 폐암 치료 새 표준 제시
아미반타맙과 레이저티닙 병용 요법이 EGFR 돌연변이 비소세포폐암 1차 치료에서 전체생존기간을 의미 있게 개선하는 것으로 확인됐다. 조병철 연세암병원 폐암센터 교수팀이 이끄는 다국가, 무작위 배정 임상 3상 연구에서 이 병용 요법은 기존 표준치료제 오시머티닙 대비 사망 위험을 25% 낮춘 것으로 밝혀져, 세계 종양학계를 주목하게 만들고 있다. 업계는 이번 임상 결과를 ‘글로벌 폐암 치료 패러다임 전환의 기점’으로 평가하고 있다.
이번 연구는 치료력이 소진된 EGFR(상피세포성장인자수용체) 돌연변이 폐암 환자를 대상으로 했다. 아미반타맙은 EGFR 변이와 MET 변이를 동시에 저해하는 이중 표적 항체 신약이며, 레이저티닙은 EGFR 유전자 엑손20 변이에 특화된 국산 표적항암제다. 두 약제 병용은 무진행생존기간 뿐만 아니라 전체생존율까지 향상시키는 성과를 냈다는 점이 역대 임상과 차별화된다. 실제로 병용군의 3년 생존율은 60%로, 오시머티닙 대비 9%포인트 개선됐다. 전체생존기간 중앙값에서도 병용군은 관찰기간을 넘어선 반면, 오시머티닙군은 36.7개월에 머물렀다.
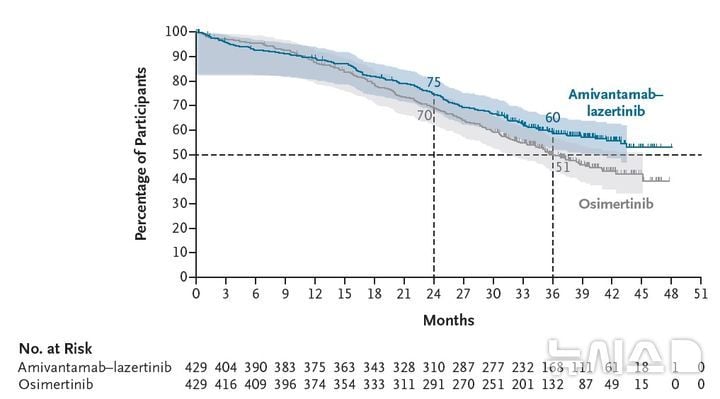
기술적으로 주목할 점은 병용요법이 일반적인 1세대 EGFR 억제제의 내성을 2배가량 더 늦추는 메커니즘을 제공한다는 것이다. 특히 뇌 전이가 동반된 고위험군 환자에서도 생존율 개선이 확인돼, 임상현장에서의 실효성이 높게 평가된다. 주요 부작용 역시 피부 발진, 손발톱 주위 염증 등으로, 관리가 용이하다는 점에서 환자와 의료진 양측 수용도가 높아질 것으로 보인다.
EGFR 돌연변이 폐암은 전체 비소세포폐암의 40% 내외를 차지하며, 매년 45만명 이상의 신규 환자가 발생할 정도로 글로벌 환자 기반이 크다. 기존 오시머티닙 단독치료의 한계였던 내성 문제와 제한된 생존기간이 이번 병용전략에 의해 개선된 것이다. 미국 식품의약국(FDA)은 이번 병용요법의 무진행생존기간 효과를 근거로 2023년 8월 신규 적응증 승인을 부여했고, 국내 식약처 역시 두 약품 모두 개별 기준 통과를 완료했다. 이는 국산 신약이 글로벌 임상표준 무대에서 실질적 치료전략으로 인정받는 첫 사례로 의미가 크다.
종양학 분야 최고 권위 학술지로 꼽히는 뉴잉글랜드저널오브메디신(NEJM)에 해당 임상 결과가 등재되며, 한국 연구진의 항암제 임상성과도 한 단계 격상됐다. 환자 생활의 질 개선과 더불어 무화학요법 기반의 새로운 표적치료 전략이 표준치료로 자리잡을 기반이 마련됐다는 평가도 나온다.
글로벌 제약기업들 역시 차세대 EGFR 표적치료제 개발에 힘을 쏟고 있으나, 아미반타맙·레이저티닙 병용처럼 내성과 전체생존기간을 동시 개선한 임상 근거는 아직 제한적이다. 유럽, 미국, 일본 등 주요 암센터에서도 이번 연구 성과에 주목하며 국내 치료경험 및 데이터 공유를 확대 중이다.
조병철 교수 연구팀은 “이번 임상 데이터를 통해 진행성 EGFR 변이 비소세포폐암 환자에서 병용요법이 무진행생존기간을 넘어 전체생존기간 개선까지 입증됐다”며 “차세대 표적치료제 중심의 대표적인 표준치료 전략으로 확산될 기반을 확인했다”고 밝혔다.
산업계는 국내에서 개발된 신약이 글로벌 치료 표준을 견인하는 전례가 만들어진 만큼, 앞으로 폐암 치료법의 판도 변화와 함께 환자 맞춤 치료 패러다임이 새롭게 확산될지 주목하고 있다.

