“시지메드텍 이노버스, 美FDA 승인 이후 첫 임상 성공→글로벌 의료기기 시장 재편 조짐”
국내 정형외과 임플란트 분야의 선두주자 시지메드텍이 척추 고정 장치 ‘이노버스 스파이널 시스템’의 미국 식품의약국(FDA) 승인 이후, 미국 현지 첫 임상 수술을 성공적으로 마쳤다. 고부가가치 의료기기 시장에서 촘촘한 기술과 신뢰의 결합은 곧 시장 질서의 변화로 귀결된다. 이번 사례는 한국 의료기기 기술력의 세계적 도약을 상징적으로 보여주는 신호탄이자, 첨단 생체적합 나사시스템 혁신의 출발점이라는 평가가 나오고 있다.
이노버스 스파이널 시스템은 2023년 2월, 미국 FDA의 510(k) 공식 인증을 획득하며 엄격한 심사 기준을 통과했다. 510(k)는 미국 내 의료기기 판매에 있어 필수인 규제로, 기존 상용 제품과의 안전성 및 효능 동등성이 검증돼야만 얻을 수 있다. 시지메드텍은 국내 제조사 중 최초로, 미국 메드트로닉사의 대표적 척추 내비게이션 플랫폼 ‘스텔스스테이션’과의 연동성을 입증하며, 혁신적 의료기비의 상용화 문을 여는 데 성공했다.
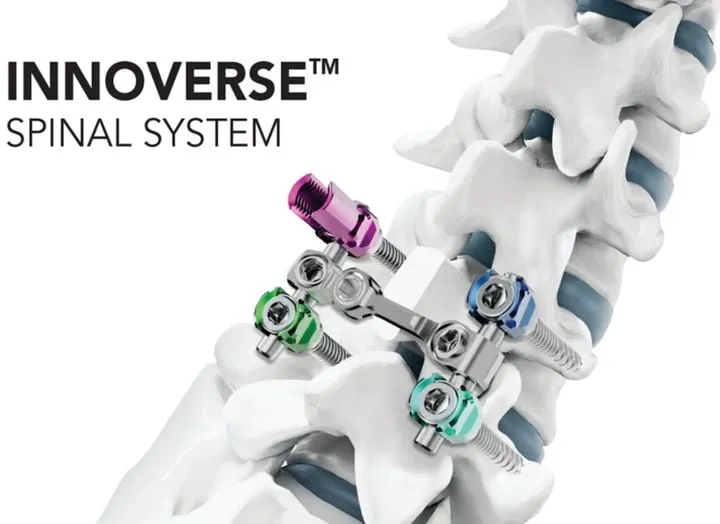
올해 3월 공식 론칭된 이노버스는 텍사스 주 ‘메모리얼 허만 병원’에서 최초로 적용됐으며, 스티븐 J. 시어 박사의 집도로 L3~S1 부위 다중 척추 유합술에 투입됐다. 제품은 직관적인 사용자 인터페이스와 스텔스스테이션 시스템과의 첨단 연동성을 기반으로, 수술의 정밀성과 효율성 모두에서 탁월한 평가를 받았다. 핵심 기술은 두 밀도 구조의 뼈에 맞춰 정밀·심부 고정이 가능한 ‘피질-해면골 복합 나사선 설계’로, 전통적 고정장치의 한계를 극복했다. 여기에 마찰형 로드 고정 구조를 채택, 수술 중 흔들림 없이 안정적으로 지지력을 제공한다.
다양한 직경(5.5㎜·6.0㎜)과 티타늄·코발트크롬 합금 소재 호환성도 미국 의료현장의 다양한 수술 환경에 효율적으로 대응하는 요소로 지목된다. 실제 현지 시술을 집도한 스티븐 J. 시어 박사는 “이중 리드 스레드로 설계된 첨단 기구류는 나사 삽입의 효율과 안전성을 현격히 높였다”고 평했다.
유현승 시지메드텍 대표는 “정밀 내비게이션 연동과 고도화된 고정장치 개발로, 미국을 비롯한 글로벌 시장에서 고난이도 척추수술 영역을 확대할 것”이라고 밝혔다. 전문가들은 첨단 의료기술과 생체재료 융합이 이끄는 차세대 임플란트 분야에서 시지메드텍과 같은 국내 기업의 약진이, 중장기적으로 글로벌 의료시장 지형을 재편할 가능성에 주목하고 있다.
