“근육까지 늘린다”…한미약품, 신개념 비만약 임상 돌입 → 혁신 치료제 기대감
CRF2 수용체를 표적으로 근육량 증가와 지방 선택적 감량을 동시에 노린 혁신 비만치료제가 글로벌 시장의 새로운 게임체인저로 주목받고 있다. 한미약품이 지난달 말 미국 식품의약국(FDA)에 비만 신약 후보 ‘HM17321’의 임상 1상 진입을 위한 임상시험계획(IND)을 공식 신청했다. 성인 건강인 대상으로 안전성과 내약성, 약동·약력학 특성까지 종합적으로 검증한다는 계획이다. 업계는 이번 시도를 ‘차세대 비만 치료제 개발 경쟁의 변곡점’으로 평가한다.
HM17321은 기존 비만약들과 달리 GLP-1(글루카곤 유사 펩타이드-1) 계열이 아닌 CRF2 수용체를 선택적으로 겨냥한 UCN2(유로코르틴-2) 유사체다. 한미약품 R&D센터의 인공지능, 구조 모델링 기반 설계 기술이 적용됐다. 동물 실험과 머신러닝 전임상 데이터에서는 지방 감량과 동시에 근육 증가, 근 기능 개선 등 통합 효능을 도출했다. 이는 “비만약 투여 시 근손실이 불가피하다”는 GLP-1 계열의 한계를 원천적으로 극복한 것으로 평가된다.
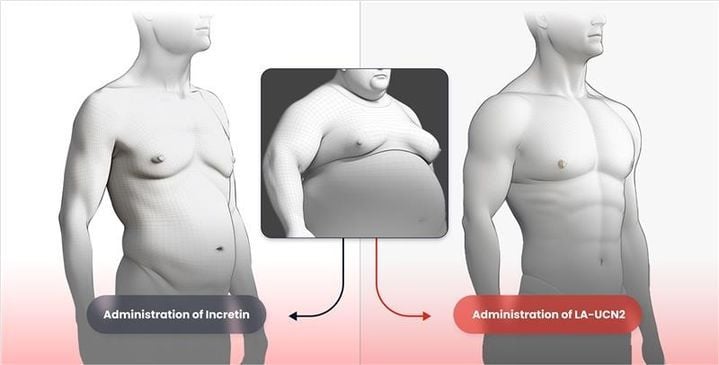
시장 적용 측면에서 HM17321의 강점은 병용과 투여 편의성에 있다. 기존 항체 기반 근육 보존 약물은 주로 정맥주사를 필요로 하고, GLP-1 비만약과의 병용도 투여 형태가 달라 한계가 컸다. 반면 HM17321은 펩타이드 약물로 피하주사 형태가 가능하며, 인크레틴 계열 약물과 동시 투여가 쉽다. 비용 측면에서도 경쟁력이 확보된다.
글로벌 제약기업들도 GLP-1 이후 차세대 비만 신약 경쟁에 본격적으로 뛰어든 가운데, 미국비만학회(Obesity Society), ADA(미국당뇨병학회), ISMB/ECCB(머신러닝 국제학회) 등에서 비임상 데이터가 연이어 발표되며 국제적 주목도가 높아지고 있다. 미국, 유럽 현지사례와 비교했을 때 효과·접근성·부작용 측면에서 차별성을 확보했다는 평가도 나온다.
비만 치료 영역에선 FDA 및 주요 규제기관의 허가 프로세스, 데이터 기반 임상 결과가 상용화의 관건으로 꼽힌다. 한미약품은 2031년 상용화 목표로, 향후 FDA 2·3상 진입과 글로벌 공동개발, 병용 적응증 확대도 추진할 방침이다.
최인영 한미약품 R&D센터장은 “지방 감량과 근육 증가, 기능 개선이라는 세 가지 환자 니즈를 한 번에 해결할 혁신 신약”이라며 “근감소증, 고령층 비만 등 기존 치료 공백을 메울 것”이라고 밝혔다. 산업계는 이번 기술이 신규 시장을 성장시킬지, 실제 임상 효과와 안전성이 검증될지 주목하고 있다. 기술·윤리·시장 규제를 둘러싼 입체적 해법이 상용화의 성공을 좌우할 것으로 보인다.

