“바이오시밀러 허가수수료 인상”…식약처, 심사역량 강화 속도
바이오시밀러(동등생물의약품) 품목허가 절차가 전면적으로 개편된다. 식품의약품안전처가 허가수수료 현실화와 심사역량 강화를 중심으로, 바이오의약품 시장의 선진화에 나선 것이다. 업계에서는 강화된 인력과 재원 확보로 허가 심사지연 문제 해소와 해외 수출 지원의 전환점이 될 수 있을지 이목이 쏠린다.
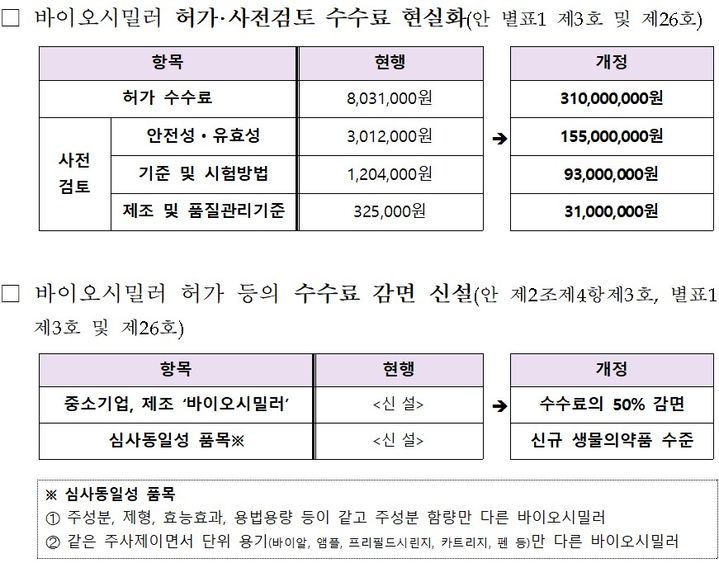
식약처는 최근 ‘의약품 등의 허가 등에 관한 수수료 규정’ 개정안을 행정예고했다. 주요 내용은 바이오시밀러 품목허가 수수료를 기존 대비 크게 조정해 3억1000만원으로 재산정한다는 점이다. 식약처는 이를 전담 심사인력 운용 및 심사자 역량 강화에 적극 투입해, 통상 406일 걸리던 허가 처리 기간을 295일까지 줄인다는 목표를 제시했다. 이번 개정은 신약에 적용된 수수료 개편 방안을 바이오시밀러까지 확대한 것으로, 지난 5일 개최된 '바이오 혁신 토론회'에서 제시된 규제 혁신 요청에 대한 신속한 후속 조치로 풀이된다.
바이오시밀러란 이미 허가된 오리지널 바이오의약품과 동등한 효능과 안전성을 입증해 개발되는 복제 바이오의약품이다. 심사 과정이 고도의 전문성과 장기간 검증을 필요로 해 양질의 심사 인력과 리소스 투입이 필수다. 이번 개정은 수수료 현실화를 통해 심사체계의 질적 향상에 방점을 찍고 있다. 특히 기존 1년 남짓 소요되던 심사 기간이 100일 이상 줄어들 전망으로, 시장 진입 속도가 빨라질 수 있다.
제약바이오 업계는 중소개발기업에 대한 부담 완화 조항에도 주목한다. 식약처는 국내 중소기업이 개발한 바이오시밀러에 대해 50% 수수료 감면을 적용하며, 동일 신청인이 유사 제품을 연속 신청할 경우 두 번째 품목부터는 800만원(전자민원 기준)으로 감면하는 방안을 동시에 도입한다. 이를 통해 신규 진입 장벽은 최소화하면서, 전체 심사 인프라 고도화를 꾀한다는 복안이다.
글로벌 시장에서는 미국, 유럽 등 선진국도 심사 전문성 및 인력의 양적 확대를 주요 과제로 삼고 있다. 국내 제도 개선이 실효성을 거둘 경우, 국산 바이오의약품의 해외 승인·진출 속도 경쟁력에서도 의미 있는 진전이 기대된다. 한편, 신약 등 기타 첨단 바이오의약품과의 제도적 정합성, 중장기적으로는 수수료 인상이 업계 부담으로 전가되는 구조 등에 대한 보완책도 향후 논의될 전망이다.
식약처 관계자는 “바이오의약품의 글로벌 진출과 허가 패러다임 혁신이 맞물리면서, 산업 전반의 지원체계 역시 질적으로 고도화될 것”이라며 “이번 개정이 실질적 산업경쟁력 향상으로 이어질 가능성에 주목하고 있다”고 밝혔다.
산업계는 이번 심사제도 개선이 실제 시장 혁신과 글로벌화 촉진으로 연결될지 예의주시하고 있다.

