“표적항암제 임상 승인 급증”…식약처, 신약 R&D 트렌드 선도
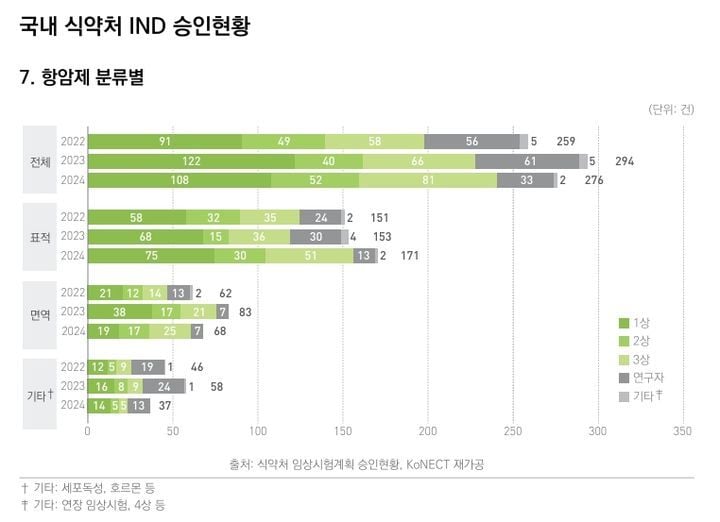
표적항암제 등 첨단 항암 신약 연구 개발이 국내 임상시험 승인 트렌드를 주도하며 바이오산업 구조의 변화를 이끌고 있다. 최근 국가임상시험지원재단의 통계에 따르면, 지난해 식품의약품안전처가 승인한 임상시험계획(IND) 747건 중 항암제가 약 37%를 차지했다. 특히 표적항암제 승인 건수가 2022년보다 20건 넘게 증가하며 항암제 전체에서도 높은 비중을 기록했다. 업계는 이를 항암 신약개발 경쟁의 변곡점으로 해석하는 분위기다.
2023년 한 해 승인된 표적항암제 IND는 171건으로 1상 75건, 2상 36건, 3상 51건이 골고루 분포했다. 전년도 1상 68건, 2상 15건, 3상 36건과 비교하면, 전 임상 단계에서 두드러진 증가세다. 임상시험 단계별 증가 추세는 신약 후보 파이프라인이 다양화되고 있음을 방증한다. 표적항암제는 종양 내 특정 유전자나 단백질을 겨냥해 부작용을 줄이고 치료 효과를 높일 수 있다는 점에서 기존 세포독성 항암제와 차별화된다.
시장별로는 폐암을 대상으로 한 임상 승인 건수가 58건으로 가장 많았고, 림프종(23건), 위·식도암(20건), 유방암(20건) 등이 뒤를 이었다. 폐암은 국내 암 유병률에서도 3위에 올라, 환자 수요가 반영된 것으로 풀이된다. 면역항암제 IND 승인 건수도 2023년에 전년 대비 33% 늘어난 83건으로 파악됐다. 면역세포를 활성화하는 면역항암제 역시 항암 치료 패러다임 전환의 한 축으로 부상하고 있다.
글로벌 시장 전망에서도 항암제 내 세부 적응증별 성장률 차이가 뚜렷해지는 모습이다. 통계에 따르면 간암 치료제는 최근 5년간 연평균 30.5%에 달하는 성장률을 기록했고, 향후 2029년까지도 21~24%의 높은 성장이 예상된다. 반면 만성림프구백혈병과 같은 일부 적응증은 향후 성장세 둔화가 전망됐다. 반대로 비호지킨림프종 등은 과거 4.6%에서 앞으로 11~14%로 더 빠른 증가세가 예측됐다.
국가임상시험지원재단 관계자는 “연평균 성장률이 높게 나타나는 분야는 연구자와 기업 관심의 확장과도 연계돼 있다”며 “원래 파이프라인이 적었던 적응증에서는 소수 연구만 늘어도 높은 성장률로 보일 수 있다는 점도 감안해야 한다”고 덧붙였다.
특히 올해 임상 프로토콜의 진화와 신약개발 전략의 정교화가 표적항암제 분야 연구를 촉진하고 있다는 평가다. 글로벌 제약기업들도 AI 기반 약물 설계와 개인 맞춤 치료 타깃을 앞다퉈 개발하며 경쟁이 확대 중이다. 미국과 유럽도 유전자/단백질 기반 항암제 임상시험이 빠르게 늘어나고 있다.
전문가들은 표적·면역항암제 임상시험의 양적 증가가 신약개발의 질적 성과로 이어지기 위해서는 임상데이터 품질관리, 규제기관과의 소통, 신속심사제도 활용 등 다각적 노력이 요구된다고 진단했다. 산업계는 이번 표적항암제 임상 확대가 실제 환자치료 및 시장 안착으로 이어질지 주시하고 있다.

