“혁신제품 사전상담 4년 성과”…식약처, 허가·인증 신속화 → 의료산업 경쟁력↑
식품의약품안전처가 혁신의약품과 의료기기 등 첨단 바이오산업 제품의 신속한 시장 진입을 지원하는 ‘혁신제품 사전상담’ 제도의 성과를 공개했다. 지난 4년간 447개 혁신제품이 사전상담을 거치며, 개발 단계가 한층 빨라지고 허가 및 인증 완료 사례도 늘어난 것으로 나타났다. 업계는 이번 제도 운영이 국내 바이오·헬스케어 시장의 ‘제품화 속도 경쟁’에 결정적 전환점을 마련했다고 평가한다.
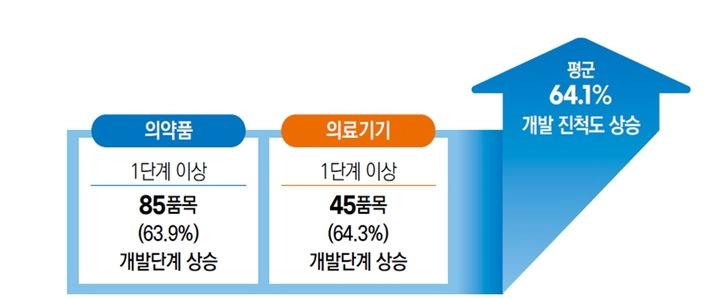
식품의약품안전처 산하 식품의약품안전평가원은 2020년 8월부터 2024년 12월까지 의약품, 바이오의약품, 의료기기 등 혁신제품 447건에 대해 사전상담을 실시했다. 이 가운데 조사에 참여한 203개 품목 중 의약품 2개, 의료기기 17개가 이미 허가·인증 완료됐으며, 의약품 48개와 의료기기 17개는 임상시험 단계로 진입했다. 특히 최초 상담 당시 비임상 단계에 있던 제품군 가운데 64%에 해당하는 85개 의약품과 45개 의료기기가 임상 등 상위 개발 단계로 진전된 것으로 집계됐다. 이를 통해 사전상담 제도가 제품 상용화의 병목을 해소하고 개발 효율을 높이는 역할을 하고 있음을 확인할 수 있다.
혁신제품 사전상담은 개발사와 규제기관 간의 초기 맞춤형 커뮤니케이션을 통해 허가자료 준비, 임상설계 전략, 신속심사 프로그램 연계 등 각종 인허가 문제를 사전 진단하고 솔루션을 제공하는 제도다. 비임상(동물실험 등)과 임상(환자 대상 연구) 간 단계 ‘점프’가 실제로 빈번하게 확인된 만큼, 길고 비용이 큰 의료제품 개발에서 타깃 전략의 핵심 단계로 부상하고 있다는 평가다.
국내 의료기기·신약 개발기업들은 “식약처의 규제 전문가와의 사전 논의를 통해 불확실성을 획기적으로 줄였다”며 실무적 체감도를 강조하고 있다. 실제로 식약처는 올해부터 비임상~임상 등 개발 각 단계별로 관련 전담 PM(제품관리자)을 배정해 밀착 모니터링하는 ‘길잡이 프로그램’을 새롭게 운영하고 있다. 의약품 18개, 의료기기 6개 품목이 집중 지원 대상으로 선정됐으며, 개발 단계별 상담, 허가자료 준비, 신속심사 프로그램(GIFT) 연계 등이 맞춤형으로 제공될 계획이다.
글로벌 바이오 및 디지털 헬스 시장 역시 각국 정부 차원의 신속 허가 체계 도입 경쟁이 본격화된 상황이다. 미국 FDA의 Breakthrough Therapy Designation, 유럽 EMA의 PRIME 등과 유사하게, 식약처도 신속심사체계의 강화와 맞춤형 사전지원 제도를 동시에 확대 중이다. 전문가들은 현 사전상담과 집중지원이 “K-헬스케어 기업의 임상·허가 리드타임을 세계적 수준으로 단축하는 분기점이 될 수 있다”고 평가한다.
이와 함께 맞춤형 상담과 개발 단계별 현장 밀착 지원이 단기적으로 산업계의 제품화 성공률을 높이는 것은 물론, 장기적으로 국내 바이오·의료기기 생태계의 글로벌 경쟁력 자체를 강화할 여지도 있다는 분석이다. 각종 규제·인허가 정보 격차, 임상 설계 미숙 등에 따른 개발 실패 리스크를 사전관리함으로써, 신시장 진입 속도를 높일 수 있을지 주목된다.
식약처 관계자는 “앞으로도 연구자와 기업의 실질적 수요를 반영한 맞춤형 상담과 집중 지원으로 의료제품의 신속한 제품화와 산업 경쟁력 제고에 적극 기여하겠다”고 밝혔다. 산업계에서는 이번 혁신제품 사전상담이 실제 시장 내 안착으로 이어질지 주시하고 있다.
