“헤모글로빈 항산화 신약 탄생”…IBS, 퇴행성 뇌질환 치료 새 해법 제시
피를 붉게 하고 산소를 운반하는 단백질로 알려진 헤모글로빈이 퇴행성 뇌질환 치료의 새로운 열쇠로 떠오르고 있다. 기초과학연구원(IBS) 인지및사회성연구단 이창준 단장은 한국과학기술연구원(KIST) 박기덕 뇌과학연구소장팀과 협력, 뇌 별세포 내 헤모글로빈의 항산화 기능을 규명하고 해당 기능을 극대화하는 저분자 화합물(KDS12025)을 개발했다고 22일 밝혔다.
연구팀은 동물실험을 통해 이 신물질로 루게릭병, 파킨슨병, 알츠하이머병 등 퇴행성 뇌신경질환, 노화, 자가면역질환 모델에서 신경손상 억제와 수명 연장 등 의미 있는 치료효과를 확인했다. 업계는 뇌 내 항산화 체계 기반 치료제라는 점에서 이번 연구를 뇌질환 치료 경쟁의 전환점으로 주목하고 있다.
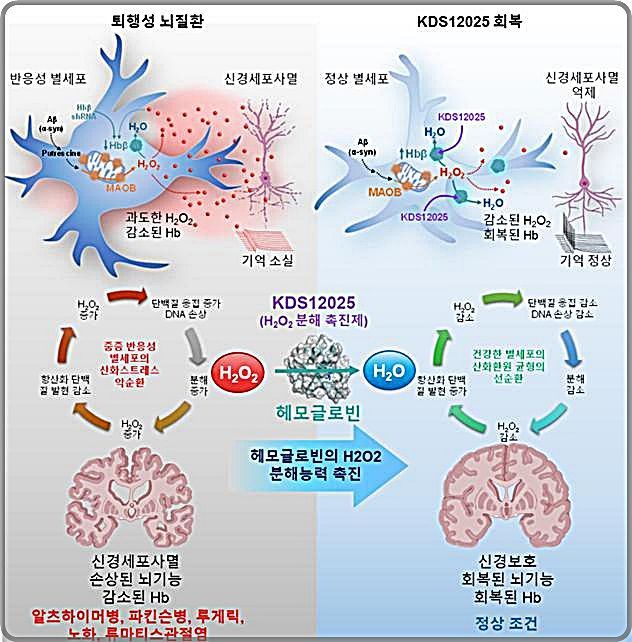
이번 성과의 핵심은 뇌 별세포(astrocyte) 내에서 헤모글로빈이 과산화수소(H₂O₂) 등 활성산소(reactive oxygen species)를 분해하는 항산화 기능을 담당한다는 점이다. 기존에는 헤모글로빈이 혈액에만 존재한다고 알려져 있었으나, 연구진은 별세포의 핵소체(nucleolus·세포핵 속 스트레스 반응·유전체 안정성 유지기관) 안에도 헤모글로빈이 존재함을 밝혔다.
별세포, 특히 반응성 별세포에서는 과산화수소가 과도하게 쌓여 신경세포를 손상시키는 것이 퇴행성 뇌질환과 노화의 주요 원인으로 지목돼 왔다. 기존 항산화 치료제들은 활성산소 라디칼 전체를 목표로 삼아 부작용이 크고 임상적 한계를 보였으나, 이번 연구는 과산화수소라는 조절 가능한 활성산소에 집중해 별세포의 항산화 체계에서 헤모글로빈의 역할을 정확히 타겟팅했다는 점이 차별적이다.
이에 따라 IBS·KIST 연구진은 헤모글로빈의 항산화 활성을 최대 100배 증폭하는 저분자 화합물 KDS12025를 개발했다. 이 신약 후보물질은 헤모글로빈 내부 철 이온과 선택적으로 결합해 과산화수소를 효과적으로 산소와 물로 전환시킨다. 혈액-뇌 장벽(blood-brain barrier)을 쉽게 통과하고, 헤모글로빈 고유 산소운반 기능에는 영향을 주지 않으면서 항산화 능력만 대폭 강화하는 것이 강점이다.
연구진은 다양한 질환 동물 모델에 KDS12025를 투여해 신경세포 사멸 억제, 생존율 향상, 기억력 및 운동기능 개선, 평균수명 연장 등 치료효과를 입증했다. 루게릭병 모델 생쥐에서는 발병과 근력저하가 지연되고 평균 생존기간이 4주 이상 늘었으며, 파킨슨병 모델의 운동 기능(회전봉 이동 시간)이 2배 이상 증가했다. 알츠하이머 모델과 노화 모델에서는 각각 기억력 회복과 평균수명 30% 연장 등 정상군에 가까운 수준의 개선이 관찰됐다.
글로벌 헬스케어 업계에서는 KDS12025가 극미량 투여로 높은 효능을 보이고, 헤모글로빈에만 특이적으로 작용해 부작용 우려가 작다는 점, 다양한 뇌질환·노화·자가면역질환 치료 플랫폼으로 확장 가능성에 주목한다. 미국, 유럽 등에서도 혈액-뇌 장벽 극복 및 선택적 항산화 기전 신약 개발이 활발히 진행 중이나, 헤모글로빈 자체의 뇌 내 항산화 메커니즘을 직접 겨냥한 정밀 신약 플랫폼은 드물다.
한편, 이 신약의 상용화까지는 추가적인 임상시험과 식약처, FDA 등 규제당국의 허가 절차가 남아 있다. 연구팀은 국제 학술지에 연구성과를 게재하며 “외부 투입 항산화제가 아닌, 인체 내 고유 단백질의 기능 제어를 통한 치료라는 새로운 접근법”을 강조했다.
전문가들은 “헤모글로빈 기반 항산화 플랫폼은 퇴행성 뇌질환 치료뿐 아니라 노화·뇌졸중 등 다양한 분야로 확대될 수 있다”며 “기술의 임상적 검증과 병행해 바이오 신약 산업 생태계 혁신을 촉진할 열쇠가 될 것”으로 내다봤다.
산업계는 이번 신약 후보 플랫폼이 실제 임상과 시장에 안착할지, 향후 글로벌 신약 경쟁 구도를 주시하고 있다.