“감염성 진단에도 CE-IVDR”…웰스바이오, 분자진단시약 8종 유럽 인증
분자진단기술이 감염성 질환 조기 진단의 혁신을 이끌고 있다. 웰스바이오는 성매개 질환과 진드기 매개 감염 등 다양한 병원체를 동시 감별할 수 있는 다중 분자진단시약 8종이 최근 유럽연합의 체외진단의료기기 규정(CE-IVDR) 인증을 획득했다고 밝혔다. 이번 인증은 고도화된 분석 성능과 품질·안전 요구 수준이 대폭 강화된 2022년 유럽 기준을 만족해야만 가능하다. 업계는 “글로벌 분자진단 경쟁의 분기점”으로 평가한다.
웰스바이오가 이번에 CE-IVDR을 획득한 제품군에는 성매개 감염 질환 진단키트 6종과 진드기 매개 감염질환 진단키트 2종이 포함된다. 실제 ‘케어진 에스티디-12 디텍션 키트’는 주요 성매개 질환 유발 병원체 12종을 동시에 검출하며, ‘케어진 에이치피브이 스크리닝 키트 에이치’는 자궁경부암 발생 위험이 높은 고위험군 인유두종바이러스(HPV) 14종을 선별할 수 있다. 고감도 동시 다중 검출이 가능한 Real-time PCR(중합효소연쇄반응) 원천기술을 기반으로 해 기존 단일 병원체 진단 대비 정확도와 효율이 높아진 것이 특징이다.
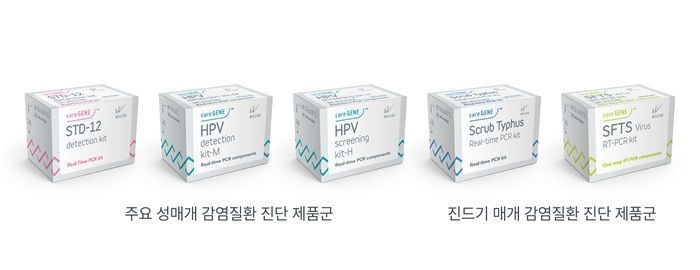
해당 기술적 구현은 유전자 증폭 과정에서 다양한 병원체를 동시에 탐지할 수 있도록 설계된 탐침(Probe)과 시약 구성에 있다. 최대 12종 이상의 병원체를 한 번에 분석하는 방식으로 기존 1종 단독 분자진단 대비 검사 시간과 비용을 대폭 절감할 수 있는 것이 강점이다. CE-IVDR 기준은 기존 IVDD 지침 대비 데이터 기반 성능 검증, 지속적 품질관리 등 준수사항이 까다롭다.
분자진단시약은 병원, 진단랩, 공공의료기관 등에서 감염환자 조기 스크리닝, 맞춤 치료법 선정, 효율적 감염병 관리 등에 활용된다. 특히 저개발국이나 진료 접근성이 낮은 지역에서 다중 검출 기반 체외진단에 대한 의료현장의 수요가 꾸준히 증가하는 추세다.
진단시장 글로벌 경쟁도 치열하다. 미국, 유럽 주요 체외진단 기업 역시 다중 분자진단 PCR 플랫폼의 상용화와 CE-IVDR 등의 인증 획득에 경쟁적으로 나서고 있다. 웰스바이오의 이번 인증 획득은 국내 체외진단 기업이 유럽 규정의 고도화 장벽을 넘어섰다는 점에서 의미가 크다는 평가다.
향후 유럽 내 체외진단의료기기 진입장벽은 CE-IVDR로 인해 한층 높아졌다. 각종 위생, 데이터·임상 기반 성능 입증, 리스크 관리 등 까다로운 인증 프로세스를 거쳐야 한다. 이와 함께 글로벌 분자진단기업은 시장과 규제 동향에 맞춘 제품 개발 전략이 필수다.
이민전 웰스바이오 대표이사는 “이번 CE-IVDR 획득은 다중 분자진단 기술력이 국제적 품질 기준을 충족했다는 의미”라며 “글로벌 진단 시장에서 제품 포트폴리오를 확대해 나가겠다”고 밝혔다. 업계는 기술과 규제 장벽을 모두 뛰어넘는 기업만이 유럽을 필두로 한 세계 체외진단 시장에서 성장의 기회를 찾을 수 있을지 주목하고 있다.
