“빛으로 세포 사멸 조절”…UNIST, 광스위치 분자 원천기술 발표
빛의 파장이 세포 내에서 특정 분자의 조립과 분해를 정밀하게 조절, 궁극적으로 세포 사멸을 유도할 수 있는 새로운 광스위치 분자 기술이 등장했다. 울산과학기술원(UNIST) 유자형 교수 연구팀이 개발한 이 기술은 자외선과 가시광선을 반복적으로 조사해 세포의 미토콘드리아를 선택적으로 파괴한다는 점에서 피부암 등 표재성 암 치료의 가능성을 높였다는 평가다. 업계에서는 빛을 직접 전달할 수 있는 암 치료, 세포소기관 기능 조절 기초연구 등 바이오 분야 패러다임 전환의 분기점으로 주목하고 있다.
유자형 교수팀은 10월 8일 국제학술지 나노 레터스에 게재된 논문을 통해, 광(光) 스위치 분자 ‘Mito-AZB’를 자체 개발했음을 밝혔다. 이 분자는 빛의 파장에 따라 조립(가시광선 450nm)과 분해(자외선 350nm)가 자유롭게 반복되며, 표적 세포 내 미토콘드리아 막에 물리적 압력 스트레스를 가해 세포 자살(apoptosis)을 유도한다. 조명 제어에 따라 미토콘드리아 막이 ‘쥐었다 폈다’ 반복적으로 자극되는 점이 이 메커니즘의 핵심이다.
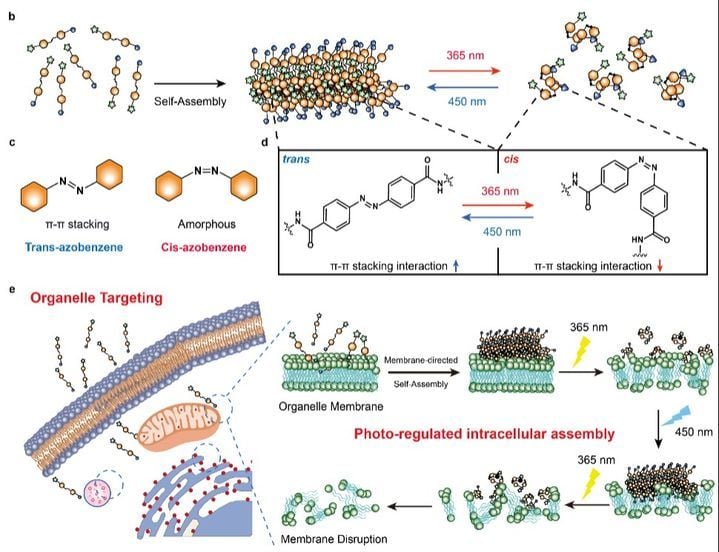
Mito-AZB는 미토콘드리아를 정확히 겨냥하는 ‘길잡이’ 성분과 빛에 따라 결합력을 바꾸는 아조벤젠 구조, 그리고 분자 관찰을 위한 형광염료가 결합한 복합체다. 가시광선 조사 시 단단한 섬유 형태로 조립되고, 자외선으로는 이를 다시 분해, 구조의 변화에 따라 미토콘드리아 막이 반복적으로 손상을 받아 세포 사멸 신호물이 유출된다. 기존 약물 접근 방식과 달리 “빛”이라는 비침습적 외부 자극으로 세포 내 분자기계 작동을 직접 제어할 수 있다는 점에서 큰 차별성이 부각된다.
특히 연구팀은 미토콘드리아 외에도 리소좀, 소포체 등 서로 다른 세포소기관의 선택적 표적화가 가능함을 확인했다. 실제로 ‘모폴린’ 구조는 리소좀, ‘토실기’ 구조는 소포체를 목표로 삼아 각 기관의 막을 광조절로 파괴하는 데 적용됐다. 이로써 단순 암 치료뿐 아니라, 비정상 세포소기관 기능을 일시적으로 차단하거나 활성화하는 정밀 바이오 연구 플랫폼으로서도 범용 확장이 기대된다.
지금까지 표재성 암 치료에서는 제한된 레이저 조사, 약물 전달 등에 의존해 왔으나, 광스위치 분자는 비침습적·실시간 제어가 가능하다는 점에서 글로벌 경쟁력 강화 요소로 주목받고 있다. 미국, 일본, 유럽에서도 광유도 약물 전달이나 광유전자 조작 연구가 활발히 진전 중이나, 세포소기관 막의 ‘가역적 스트레스 부여’ 방식은 국내에서 처음으로 제안된 성과다.
한편, 빛을 이용한 세포조절 기술이 의료현장에 도입되기까지는 안전성, 표적 정확성, 조직 투과성 등 규제적·기술적 검증이 남아 있다. 국내에서는 식약처의 의료기기·의약품 허가와 더불어 생명윤리 기준에 대한 지속적 논의가 필요하다. 실제 상용화 논의에 앞서, 데이터 축적과 글로벌 기준에 부합하는 임상 설계가 관건으로 떠오르고 있다.
유자형 UNIST 교수는 “광스위치 분자가 빛을 외부 자극으로 해 세포 내 분자기계 상태를 조절하고, 실제 세포 반응까지 제어할 수 있음을 처음 증명한 데 의의가 있다”고 밝혔다. 업계는 표재성 암 치료와 함께 세포소기관 기능해석, 희귀질환 연구 등 다양한 바이오·의료 응용 확장에 주목하고 있다. 산업계는 이번 기술이 실제 시장에 안착할 수 있을지 주시하고 있다.

