“FDA 심사수수료 65억원 인상”…바이오 기업 신약개발 비용 부담 커진다
미국 식품의약국(FDA)이 2026년 회계연도 신약 허가 심사수수료를 약 65억원으로 인상했다. 반면, 바이오시밀러(바이오의약품 복제약) 심사 수수료는 크게 낮췄다. 신약개발에 본격적으로 나서려는 제약·바이오기업들은 실제 승인에 드는 고정비가 크게 올라가는 한편, 복제약·바이오시밀러 분야는 비용 부담이 완화될 전망이다. 업계는 이번 조치를 글로벌 규제 환경 변화의 신호탄이자, 혁신신약 개발 경쟁의 중대한 변곡점으로 바라보고 있다.
FDA는 지난달 30일 신약(전문의약품), 제네릭(복제약), 바이오시밀러, 의료기기 4대 산업군을 대상으로 2026년 회계연도(2025년 10월 1일~2026년 9월 30일) 허가 심사수수료를 연방 관보에 확정 게재했다. NDA(신약승인신청), BLA(생물의약품허가신청) 등 전문의약품의 허가 심사수수료는 468만2003달러로, 올해 431만달러(약 60억원)에 비해 37만달러(약 8.6%) 인상됐다. 제네릭 의약품 수수료는 11.3%, 의료기기는 7.1% 인상되는 반면, 바이오시밀러는 18.4% 인하돼 대조적인 정책 변화를 보였다.
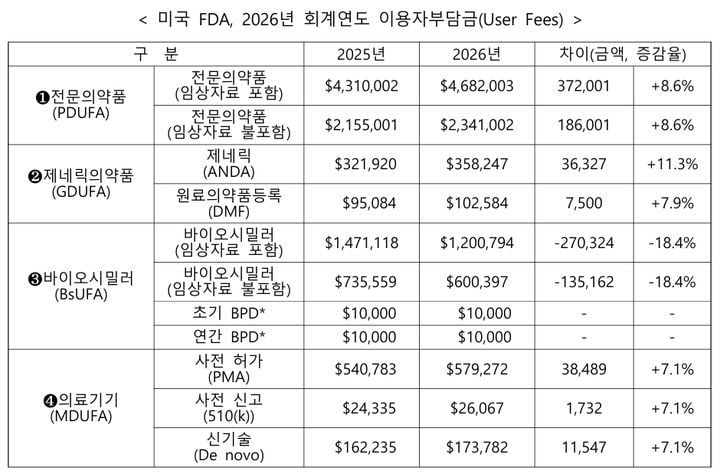
FDA는 매년 인플레이션, 심사건수 변화, 제조시설 증감, 심사자 인건비 증가 등을 반영해 이용기업에 합리적인 심사 원가를 분담시킨다는 입장이다. 2026년 회계연도에는 NDA·BLA 심사 건수가 2971건에 이를 것으로 추산되며, 이 중 희귀의약품 등 약 156건은 각종 법령에 따라 수수료 면제 대상이어서 실제 징수 대상은 2815건으로 집계된다. 바이오시밀러의 경우, 개발기업과 FDA 심사관 간 공식 미팅 프로그램(BPD)이 올해 120건에서 내년 150건까지 늘어날 것으로 전망돼 시장 확대에 대한 정책적 배려가 엿보인다.
특히 이번 조치는 연구개발 부담이 극심한 혁신신약 개발 기업들에 대한 비용 구조 변화로 이어질 전망이다. 신약심사 수수료는 단일 승인당 65억원에 달해 글로벌 빅파마조차 R&D 프로젝트별 승인 예산이 상당한 압박 요인으로 작동할 수 있다. 반면 바이오시밀러와 제네릭 분야는 규제 장벽이 다소 낮아지면서, 복제약 시장 진입에 긍정적으로 작용할 수 있다는 평가다.
글로벌 시장에서는 FDA 심사 행정비용 증가와 민감한 수수료 조정이 미국 이외 각국 규제기관에도 파급될 가능성에 주목하고 있다. 유럽의약품청(EMA), 일본 후생노동성(MHLW) 등도 최근 복제약 허가절차 간소화, 혁신신약 임상자료 요건 강화 등 유사방향 흐름을 보이고 있다.
업계 전문가들은 “FDA의 수수료 조정은 신약개발·시장진입 전략 전반에 영향을 준다”며 “규제 투명성이 제고된 반면 신약 혁신과 산업 구조 전환에 새로운 진입장벽이 될 수 있다”고 분석했다.
제약·바이오 산업계는 이번 심사수수료 인상이 실제 투자와 사업화 의사결정, 글로벌 기술이전 계약 등에 어떤 변화를 촉발할지 주목하고 있다. 기술의 진화 속도뿐 아니라, 제도·규제 환경 변화가 산업 경쟁력의 새로운 관건이 될 전망이다.
